缺氧0号元素挖掘方法 缺氧0号元素怎么挖掘
2024-02-14来源:网络作者:游戏洛
0号元素的表示法
在某些文献中,0号元素被简记为0Nu或0Nt,这一词来自neutrium ,但大部分的文献还是以“中子”记载,记为小写n,大写N会与氮元素冲突,另外也有将n重复两次避免与氮元素冲突的写法:0nn 。

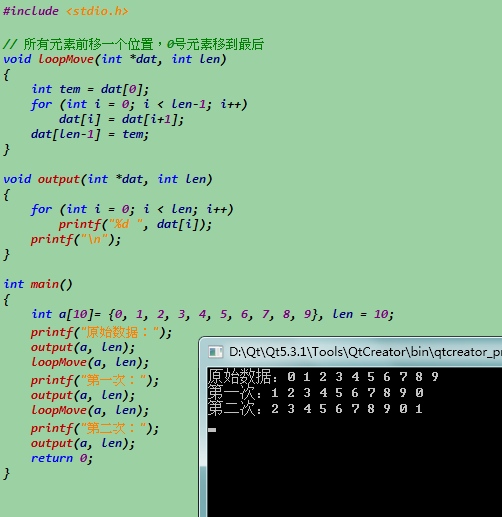
用C语言编程:将整形数组中的所有元素前移一个位置...
用for循环逐步移动即可。
#include <stdio.h>// 所有元素前移一个位置,0号元素移到最后
void loopMove(int *dat, int len)
{
int tem = dat[0];
for (int i = 0; i < len-1; i++)
dat[i] = dat[i+1];
dat[len-1] = tem;
}
void output(int *dat, int len)
{
for (int i = 0; i < len; i++)
printf("%d ", dat[i]);
printf("/n");
}
int main()
{
int a[10]= {0, 1, 2, 3, 4, 5, 6, 7, 8, 9}, len = 10;
printf("原始e799bee5baa6e58685e5aeb931333337613836数据:");
output(a, len);
loopMove(a, len);
printf("第一次:");
output(a, len);
loopMove(a, len);
printf("第二次:");
output(a, len);
return 0;
}
100号元素镄是谁首先发现的?
1952年,美国原子能委zd员会的洛斯·阿拉莫斯(Los Alamos)、乔克(Ghiorso A.)及其同事们从太平洋的安尼维托克岛所专试验的一次氢弹核爆炸的碎片中分离出。 为纪念第一个用中于轰击铀的意大利出生的物理学家费米(Fermi E.),第100号元素取名为“Fermium”,属中文名称为镄(Fm)。很急需知道免疫力和微量元素的关系!!!
微量元素对人体有何作用在人类维持生命所需的营养物质中,微量元素是其中的一大类。而每一种微量元素,又有其特殊的生理功能。在某种情况下,一种微量元素可以产生多种特殊的生理作用。尽管它们的体内的含量只有万分之几,有的甚至仅有十亿分之几,但是如果缺少了这微乎其微的任何一种物质,生命很可能因此而终止。
人体内的微量元素包括:
人体内的微量元素包括:
1、常量元素:钙、氮、氧、氢、碳、硫、磷、镁、钾、钠、氯等,含量均占体重的1/万以上。
2、微量元素:钒、锰、铁、钴、铜、锌、硒、碘等。那么,每种微量元素在人体中究竟有什么样的生理功能呢?我们重点介绍以下几种:
钙是构成骨骼及牙齿的主要成分。钙对神经系统也有很大的影响,当血液中钙的含量减少时,神经兴奋性增高,会发生肌肉抽摔。钙还可帮助血液凝固。
磷 是身体中酶、细胞核蛋白质、脑磷脂和骨骼的重要成分。
铁 是制造血红蛋白及其它铁质物质不可缺少的元素。
铜 是多种酶的主要原料。
钠 是柔软组织收缩所必需元素。
钾 钾与钙的平衡对心肌的收缩有重要作用。
镁 可以促进磷酸酶的功能,有益骨骼的构成;还能维持神经的兴奋,缺乏时有抽搐现象发生。
氟 可预防龋齿和老年性骨质疏松。
锌 是很多金属酶的组成成分或酶的激动剂,儿童缺乏时可出现味觉减退、胃纳不佳、厌食和皮炎等。
硒 心力衰竭、克山病、神经系统功能紊乱与缺硒有关。
碘 缺乏时,可有甲状腺肿大、智力低下、身体及性器官发育停止等症状。
锰 成人体内含量为12~20mg。缺乏时可出现糖耐量下降、脑功能下降、中耳失衡等症状。
另外,还需要给大家介绍两种有毒金属。
铝:可造成低血钙、小儿多动症及关节病等。铅:可造成行为及神经系统的异常。平时我们应少接触它们,以免对身体造成损害。
关于人体中各种微量元素含量在临床上的具体意义,我们现根据有关资料摘编如下:
一、碘(I)
碘是通过甲状腺素而发挥其生理作用,所以甲状腺素所有的生物学作用,包括促进蛋白质的合成,活化多种酶,调节能量转换,加速生长发育,维持中枢神经系统结构,保持正常的生理功能,机体的新陈代谢、蛋白质的合成、分解与新陈代谢等重要功能,都与碘有关。缺碘可引起如下疾病:7a686964616f31333236393665
1、地方性甲状腺肿
(1)、临床表现
甲状腺肿大,患者颈部逐渐变粗,无明显自觉症状,当肿大甲状腺组织压迫周围器官时,产生呼吸困难,吞噬困难。
(2)、诊断
患者有病区生活史,尿碘低于50ug/g肌酐,无甲状腺功能亢进临床表现。
(3)、治疗与预防
a、口服碘盐 世界大多数国家都采用食盐加碘的方法,预防甲状腺肿。
b、口服碘剂 碘化钾10—15mg/d,复方碘液2—3滴/d,口服药对早期患者疗效较好,对晚期已经形成结节性甲状腺肿时疗效不甚满意。
c、碘注射液 0.66g/L的碘注射液,注射到甲状腺局部,对结节性甲状腺肿疗效较好。
2、地方性克汀病
(1)、临床表现
智力低下,聋哑,生长发育迟缓,身材矮小,神经运动障碍及甲状腺功能低下。
(2)、治疗与预防
a、用口服碘盐和口服碘剂预防克汀病,阻断遗传和先天性病源。
b、碘化油 碘化油肌肉注射。
3、含碘食物简介 单位(mg/kg)
大米 麦子 玉米 高粱 白薯
12 9 31 10 24
黄豆 鸡蛋 菠菜 葡萄 水
21 97 58 15 0.9
二、铁(Fe)
铁是人体必需微量元素,铁在人体中分布很广,几乎所有组织都含有铁,是人体发育的“建筑材料”。铁是血红蛋白的重要组成部分,血液中输送氧与交换氧的重要元素。铁又是许多酶的组成成分和氧化还原反应酶的激活剂。缺铁可引起如下疾病:
1、缺铁性贫血
(1)、临床表现
临床表现与贫血程度有关,严重者除有一般贫血症状外,可发生肝、脾、淋巴结肿大和四肢水肿。
(2)、治疗
口服铁剂,硫酸亚铁最常用,每次0.3—0.6g,三次/d,6—8周为一个疗程,隔3—6个月再复治一次,注射铁剂用含糖氧化铁或右旋糖酐铁,小剂量静脉注射,首次不超过25—50mg,如无反应可逐渐增至150mg/d。
2、溶血性贫血
临床表现多为急性中毒,肢体酸痛、头痛、呕吐、寒战、高热、面色苍白、黄疸、肝脾肿大、血尿、急性肾功能衰竭、尿毒症。
3、再生障碍性贫血
由于红骨髓显著减少、造血功能衰竭而引起的一种综合症,以全血细胞减少为主要临床表现。用铁剂、维生素B12雄性激素治疗,可提高人体对铁的利用,刺激亚铁血红素的合成。
4、含铁食品简介 单位(mg/100g)
干黄豆 绿豆 蚕豆 鲜毛豆 芝麻 芹菜
11 6.8 7 6.4 50 8.5
韭菜 黄豆芽 茄子 胡萝卜 番茄 辣椒
1.7 1.8 0.4 0.6 0.8 0.7
茴香 葱头 大白菜 小白菜 青蒜 菜花
1.2 1.8 0.6 1.8 0.6 0.7
藕 菠菜 海带 紫菜 黑木耳 鸡蛋
0.5 1.8 150 33 185.2 2.7
三、锌(Zn)
锌是人体必需微量元素,是构成人体多种蛋白质所必需的元素。蛋白质是构成人体细胞的大部分固体物质,锌与蛋白质和核酸的合成有密切关系。锌能维持细胞膜的稳定性并参与许多酶的代谢。锌的缺乏可引起如下疾病:
1、营养性侏儒症
本病多发于儿童、青少年,影响生长发育。表现为生长发育停滞,骨骼发育障碍,智力及性功能低下,肝脾肿大,皮肤粗糙,
色素沉着,伴有贫血,食癖症。体格检查可发现血清锌及头发锌低,不及时补锌治疗,可导致侏儒症发生。
2、肠原性肢体皮炎
临床表现为持续性间断性腹泻及口腔炎。肛门、外生殖器区、膝部、踝部、小腿、足、肘等部位瘙痒和炎症。伴有食欲不佳、精神不振、头发变棕浅色、脱发等,不积极治疗可引起败血症。
3、原发性男性不育症
缺锌时机体受累最严重的为生殖过程,性成熟受到严重的影响。成人缺锌可发生性腺萎缩,性功能低下,化验检查发现,男性血清睾丸素及锌水平低下,精子数目减少,用锌治疗可收到良好的效果。
4、锌有保护肝脏的作用
缺锌时血浆氨含量增高,补充适量的锌则可使血浆氨减少。此外病毒性肝炎患者的血清锌含量也降低。肾功能不全的病人也缺锌。
5、其他
局限性回肠炎、白血病、失血、低蛋白血症、急性心肌梗死患者缺锌。
四、铜(Cu)
铜广泛分布于动物组织上,也是人体必需微量元素之一,参与人类生命活动。人和动物都需要铜创造红细胞和血红蛋白,铜与血的代谢有关,铜缺乏时发生贫血。铜是血红蛋白的活化剂,参与许多酶的代谢。铜缺乏可引起如下疾病:
1、贫血
一般最常见的临床表现为头晕、乏力、易倦、耳鸣、眼花。皮肤黏膜及指甲等颜色苍白,体力活动后感觉气促、心悸。严重贫血时,即使在休息时也出现气短和心悸,在心尖和心底部可听到柔和的收缩期杂音。
2、骨骼改变
临床表现为骨质疏松,易发生骨折。
3、铜与冠心病
4、铜与白癜风病
5、女性不孕症
五、硒(Se)
硒是人体必需微量元素,近些年来各国学者对硒的研究有突破性进展,研究硒的分布、含量与疾病的关系,进行大规模、超国家和地区范围的研究,发现硒与心血管疾病、大骨节疾病、肿瘤、地方性病有密切关系。
1、硒与心血管疾病
根据流行病学调查,缺硒地区人群的高血压、心脏病和冠心病的死亡率比富硒区高3倍。还发现风湿性心脏病、脑血栓和动脉粥状硬化等病的死亡率,在高硒地区也明显低于低硒地区。这说明缺硒与心、脑血管疾病发病率与死亡率密切相关。国外有人用硒治疗冠心病、心绞痛取得很好的疗效,我国用硒防治克山病,也取得显著疗效。所以硒对心血管疾病防治有不可估量的作用。
2、硒的抗癌作用
硒化物质对未成熟白细胞生成的抑制作用特别明显。
3、硒与地方病
(1)、克山病 克山病发病快、症状重,类似缺血、缺氧性心肌坏死,病人往往抢救不及时而死亡,即使抢救过来也往往不能痊愈而拖延成慢性克山病。用亚硒酸钠0.5-2mg, 每周1次,结果发病率明显下降。可见硒对降低克山病发病有明显效果。
(2)、大骨节病、是我国西北地区流行的一种地方病,得了大骨节病,骨关节粗大,身材矮小,劳动力丧失,往往与克山病在同一地区流行。用硒及维生素E治疗有效,能够加速儿童的骨骼生长。
六、钴(Co)
钴是维生素B12的组成成分,是一种独特的营养物质,列为人体必需的微量元素。钴缺乏可引起如下疾病:
1、 巨细胞性贫血
钴有刺激造血的功能,其机制可能是通过促进胃肠道内铁的吸收,并加速储存铁的动用,使之较易被骨髓利用;钴能抑制细胞内很多重要呼吸酶,引起细胞缺氧,促使红细胞生成素(EPO)合成增多。上述的最后结果为代偿性的造血功能增加,钴能通过维生素B12参与核糖核酸及造血系统有关物质的代谢。维生素B12
含有5%钴的复合物。除钴外还有氮和磷,又称钴胺素,若维生素B12缺乏,可使骨髓细胞的DNA合成前期和合成后期的时间延长,从而引起巨幼红细胞贫血。
2、白血病
钴对体内多种生物合成过程起重要作用,尤其是对核酸的生物合成作用,这可能是白血病的病因所在。
3、白内障
有人认为钴可以引起白内障,其原因在于钴干扰钙离子,导致钠和钾通透性改变,有人发现钴在老年性白内障晶体中含量增高,也有人认为是蛋白酶的抑制剂。
4、其他疾病
钴是维生素B12的主要成分,维生素B12缺乏可引起口腔及舌的溃疡、炎症及骨髓退行性病变,给予维生素B12治疗可收到疗效。
5、缺钴引起的疾病的防治
氯化钴用以治疗贫血,成人120mg/d,儿童每天2—4mg,分3次口服,疗程3个月为宜。副作用有消化道反应、心动过速和心率不齐、甲状腺肿大、多毛、痤疮和皮肤色素沉着,停药后会自然消失。
几种食物中含钴量(ug/g)
大米 牛肉 猪肉 油及脂肪 牛奶
0.10 0.52 0.17 0.37 0.06
红塘 白糖 蛋类 水果 核桃花生
0.4 0.05 0.10 0.14 0.26
七、锰(Mn)
锰是人体必需的微量元素,参与人体糖、脂肪的代谢。凝血机制、生长发育神经及内分泌系统等均与锰生物学作用有关。缺锰可以引起如下疾病:
1、侏儒症
锰是硫酸软骨素合成酶的必需辅助因子,与结缔组织韧性及硬度、粘多糖的合成、硫酸软骨素及钙、磷代谢密切相关。缺锰使软骨生长障碍,长骨缩短弯曲甚至畸形,发育停滞,引起侏儒症。
2、贫血
锰有刺激红细胞生成素和促进造血的作用。锰与贫血密切相关。
3、肿瘤
缺锰可能影响有致病性的亚硝酸盐不能还原而致癌。
4、几种含锰的食物(ug/g)
调味品及香料 坚果 谷类 蔬菜和水果
91.8 17.7 7 0.44—3.47
非酒精饮料 肉类 奶制品 海味
3.8 0.21 0.07 0.05
八、铬(Cr)
铬参与人体脂肪和糖的代谢
求初三到高一化学总结知识点
初三化学上册1-6单元知识点汇总1、化学是一门研究物质的组成、结构、性质以及变化规律的以实验为基础自然科学。
2、化学变化和物理变化的根本区别是:有没有新物质的生成。化学变化中伴随发生一些如放热、发光、变色、放出气体、生成沉淀等现象。
3、物理性质——状态、气味、熔点、沸点、硬度、密度、延展性、溶解性、挥发性、导电性、吸附性等。
4、化学性质——氧化性、还原性、金属活动性、活泼性、稳定性、腐蚀性、毒性等
可燃性、能支持燃烧、能与某物质反应
(空气)
1、空气中氧气含量的测定:实验现象:①红磷(不能用木炭、硫e79fa5e9819331333335313132磺、铁丝等代替)燃烧时有大量白烟生成,②冷却后打开止水夹,烧杯中的水进入集气瓶,最后水占集气瓶中空气体积的1╱5。
若测得水面上升小于1/5体积的原因可能是:①红磷不足,氧气没有全部消耗完②装置漏气③没有冷却到室温就打开弹簧夹。
2、法国化学家拉瓦锡提出了空气主要是由氧气和氮气组成的。舍勒和普利斯特里先后用不同的方法制得了氧气。
3、空气的成分按体积分数计算,大约是氮气为78%、氧气为21%(氮气比氧气约为4∶1)、稀有气体(混合物)为0.94%、二氧化碳为0.03%、其它气体和杂质为0.03%。空气的成分以氮气和氧气为主,属于混合物。
4、排放到大气中的有害物质,大致可分为粉尘和气体两类,气体污染物较多是SO2、CO、NO2,O3。
SO2、CO、NO2主要来自矿物燃料的燃烧和工厂的废气。
氧气的性质1、通常状况下,氧气是无色无味的气体,密度比空气略大,不易溶于水,液氧是淡蓝色的
2、、氧气是一种比较活泼的气体,具有氧化性、助燃性,是一种常用的氧化剂。
①(黑色)C和O2反应的现象是:在氧气中比在空气中更旺,发出白光。
②(黄色)S和O2反应的现象是:在空气中淡蓝色火焰,在氧气中蓝紫色的火焰,生成刺激性气味的气体SO2。
③(红色或白色)P和O2反应的现象是:冒大量的白烟,生成白色固体(P2O5),放出热量(用于发令枪)
④(银白色)Mg和O2反应的现象是:放出大量的热,同时发出耀眼的白光,生成一种白色固体。(用于照明弹等)
⑤(银白色)Fe和O2反应的现象是:剧烈燃烧,火星四射,生成黑色固体Fe3O4,注意点:预先放入少量水或一层沙,防止高温熔化物落下来炸裂瓶底。
⑥H2和O2的现象是:发出淡蓝色的火焰,放出热量 ⑦CO和O2的现象是:发出蓝色的火焰,放出热量
⑧CH4和O2的现象是:发出明亮的蓝色火焰,放出热量。
一、分子和原子、元素
1、分子是保持物质化学性质的最小粒子(原子、离子也能保持物质的化学性质)。原子是化学变化中的最小粒子。
分子的特点:分子的质量和体积很小;分子在不断运动,温度越高分子运动速率越快;分子间有间隔,温度越高,分子间隔越大。
物质三态的改变是分子间隔变化的结果,物体的热胀冷缩现象,就是物质分子间的间隔受热时增大,遇冷时缩小的缘故,
2、原子是化学变化中的最小粒子
原子间有间隔,温度越高原子间隔越大。水银温度计遇热汞柱升高,就是因为温度升高时汞原子间间隔变大,汞的体积变大。
例如:保持氧气化学性质的最小粒子是氧分子。保持CO2化学性质的最小粒子是CO2分子;保持水银的化学性质的最小粒子是汞原子。在电解水这一变化中的最小粒子是氢原子和氧原子。
原子中:核电荷数(带正电)=质子数=核外电子数 相对原子质量=质子数+中子数
原子是由原子核和核外电子构成的,原子核是由质子和中子构成的,构成原子的三种粒子是:质子(带正电荷)、中子(不带电)、电子(带负电荷)。一切原子都有质子、中子和电子吗?(错!有一种氢原子无中子)。
某原子的相对原子质量=某原子的质量/C原子质量的1/12。相对原子质量的单位是“1”,它是一个比值。相对分子质量的单位是“1”,一般不写。
由于原子核所带电量和核外电子的电量相等,电性相反,因此整个原子不显电性(即电中性)。
2、①由同种元素组成的纯净物叫单质(由一种元素组成的物质不一定是单质,也可能是混合物,但一定不可能是化合物。)
②由一种分子构成的物质一定是纯净物,纯净物不一定是由一种分子构成的。
③由不同种元素组成的纯净物一定是化合物;由不同种元素组成的物质不一定是化合物,但化合物一定是由不同种元素组成的。
纯净物与混合物的区别是物质的种类不同。
单质和化合物的区别是元素的种类不同。
④由两种元素组成的,其中一种是氧元素的化合物叫氧化物。氧化物一定是含氧化合物,但含氧化合物不一定是氧化物。
⑤元素符号的意义:表示一种元素,表示这种元素的一个原子。
⑥化学式的意义:表示一种物质,表示这种物质的元素组成,表示这种物质的一个分子,表示这种物质的一个分子的原子构成。
⑦物质是由分子、原子、离子构成的。 由原子直接构成的:金属单质、稀有气体、硅和碳。
由分子直接构成的:非金属气体单质如H2、O2、N2、Cl2等,一些氧化物,如水、二氧化碳、二氧化硫。 由离子直接构成的:如NaCl。
3、决定元素的种类是核电荷数(或质子数),(即一种元素和另一种元素的本质区别是质子数不同或者核电荷数不同);决定元素的化学性质的是原子的最外层电子数,决定元素类别的也是原子的最外层电子数。
同种元素具有相同的核电荷数,如Fe、Fe2+、Fe3+因核电荷数相同,都称为铁元素,但最外层电子数不同,所以他们的化学性质也不同。
核电荷数相同的粒子不一定是同种元素,如Ne、HF、H2O、NH3、CH4。
二、质量守恒定律
1、在一切化学反应中,反应前后①原子的种类没有改变,②原子的数目没有增减,③原子的质量也没有变化,所以反应前后各物质的质量总和相等。
小结:在化学反应中:
一定不变的是:①各物质的质量总和 ②元素的种类 ③元素的质量 ④原子的种类 ⑤原子的数目 ⑥原子的质量;
一定改变的是:①物质的种类 ②分子的种类; 可能改变的是 ①分子的数目 ②物质的状态
书写化学方程式应遵守的两个原则:一是必须以客观事实为基础,二是要遵守质量守恒定律,“等号”表示两边各原子的数目必须相等。
三、气体的实验室制取
1、反应物是固体,需加热,制气体时则用氯酸钾加热制O2的发生装置。
反应物是固体与液体,不需要加热,制气体时则用制CO2的发生装置。
2、密度比空气大且不与空气中的物质反应,可用向上排空气法, 难或不溶于水且不与水反应可用排水法收集,密度比空气小且不与空气中的物质反应可用向下排空气法。
CO2只能用向上排空气法 ;O2可以用向上排空气法收集,也可以用排水集气法收集; CO、N2、(NO)只能用排水法收集。
3、①实验室制O2的方法是:①加热氯酸钾和二氧化锰的混合物,②加热高锰酸钾,③过氧化氢溶液和二氧化锰的混合物
化学方程式:
①2KClO3==== 2KClO3+3O2 ↑
②2KMnO4====K2 MnO4+MnO2 +O2↑
③2H2O2====2H2O+O2↑
注意事项
用第一种药品制取时要注意
②试管口要略向下倾斜(防止凝结在试管口的小水珠倒流入试管底部使试管破裂)
③加热时应先使试管均匀受热,再集中在药品部位加热。
④排水法收集完氧气后,先撤导管后撤酒精灯(防止水槽中的水倒流,使试管炸裂)
用第二种药品制取时要在试管口放一团棉花(防止加热时高锰酸钾粉未进入导管)
用第二种药品制取有长颈漏斗时,长颈漏斗下端管口要插入液面以下
工业上制制O2的方法是:分离液态空气(物理变化)
原理:利用N2、 O2的沸点不同,N2先被蒸发,余下的是液氧(贮存在天蓝色钢瓶中)。
4、实验室制取CO2
(1)药品:石灰石和稀盐酸或大理石和稀盐酸(不用碳酸钙,因为碳酸钙与盐酸反应太剧烈,不容易收集;不用浓盐酸,因为浓盐酸易挥发,产生的氯化氢混在二氧化碳里,使二氧化碳不纯)
(2)反应原理:CaCO3+HCl_______
(3)发生装置:固+液 不加热型 (4)收集装置:向上排空气法
四、水
1、电解水:正、阳、氧(气);负、阴、氢(气);氢气和氧气的体积比=2:1
电解水的实验可以得出的结论:(1)水是由氢元素和氧元素组成的;(2)分子在化学反应中可以再分原子不可以分。
水的组成的正确表述:(1)水是由氢元素和氧元素组成;(2)水由水分子构成;(3)水分子由氢原子和氧原子构成(都不讲个数);(4)一个水分子由一个氧原子和二个氢原子构成(都讲个数)
2、水的净化:
某些乡村,利用明矾溶于水后生成的胶状物对杂质的吸附,使杂质沉降。
(1)自来水厂的净水过程:取水-沉淀-过滤-吸附-消毒-配水(没有蒸馏)
(2)净化水的方法:蒸馏、吸附、过滤、沉淀四种,净化程度由低到高的顺序:蒸馏、吸附、过滤、沉淀
3、硬水和软水
(1)硬水:含有较多可溶性钙镁化合物的水叫硬水;
(2)软水:不含或含较少可溶性钙、镁化合物的水叫做软水;
(3)区分硬水和软水的方法:①向盛等量水的烧杯中加入等量的两种水,搅拌,浮渣少,泡沫多是软水;浮渣多,泡沫少是硬水(蒸馏水泡沫多,无浮渣)
②把适量水放在蒸发皿中,加热蒸干,有固体剩余物是硬水,没有纯水。
(3)降低水的硬度的方法:①煮沸水;②蒸馏(过滤和吸附不能降低水的硬度)
(4)蒸馏:获取纯净水的一种方法。注意:先检查装置的气密性;在圆底烧瓶中加入沸石,防止暴沸。
五、二氧化碳和一氧化碳
1、二氧化碳的性质
(1)物理性质:通常状况下是无色、无味的气体,能溶于水,密度比空气大;在一定条件下能变成固体,二氧化碳固体叫干冰
(2)化学性质:
①不能燃烧,不支持燃烧,不能供给呼吸;
能和水反应 CO2+H2O_________________________________________________
生成的碳酸不稳定,容易分解H2CO3___________________
③能和石灰水反应:CO2+Ca(OH)2_______________________________________
④能和碳反应:CO2+C_______________________
2、CO2的检验:
①把产生的气体通入澄清石灰水,如果澄清石灰水变浑浊,证明是二氧化碳;
②把燃着的木条伸入集气瓶中,如果木条熄灭,证明是二氧化碳;
③把产生的气体通入紫色石蕊试液中,如果紫色石蕊试液变红,证明是二氧化碳。
3、二氧化碳的用途
用途 灭火 气体肥料 制汽水等饮料 干冰作制冷剂、人工降雨 化工原料
对应的性质 不能燃烧、不支持燃烧、密度比空气大 在叶绿素作用下,二氧化碳和水反应生成有机物,放出氧气 能溶于水,与反
应生成碳酸 干冰升华
吸热,使环
境温度降低 与一些物质反应生成化肥
4、CO的性质:
可燃性:CO+O2_____________________________
还原性:CO+CuO_____________________________________________________
CO+Fe2O3_________________________________________________________
CO+Fe3O4_________________________________________________________
5、一氧化碳的用途
①作燃料,是水煤气的主要成分(利用CO的可燃性)
②冶炼金属 用于炼铁(利用CO的还原性)
6、二氧化碳对人类不利的一面
①二氧化碳不能供给呼吸,当空气中二氧化碳的含量过高时,人便神志不清,最后死亡。
导致温室效应 臭气(O3)、甲烷(CH4)、CO2都能产生温室效应,叫温室气体。
②温室效应的可能后果:①两极冰川融化,海平面升高,淹没沿海城市;②土地沙漠化;③农业减产。
③大气中二氧化碳含量升高的原因:①煤、石油、天然气等化石燃料的燃烧;②人和动植物的呼吸;③森林火灾;
④怎样控制温室:①减少煤、石油、天然气等化石燃料的燃烧,②开发和利用太阳能、风能、地热新能源;③大力植树造林,严禁乱砍滥伐
6、一氧化碳对人类不利的一面
CO有毒,原因是CO与血液中的血红蛋白结合,使生物体缺氧,最后死亡。
燃烧含碳燃烧要注意通风,防止CO中毒;以煤等含碳物质作燃烧时,一定要装烟囱,并且保持通风
六、碳单质:
1、金刚石、石墨、活泩炭都是碳元素组成的单质,它们的性质不同,是因为碳原子的排列方法不同
金刚石的性质:最硬 不导电 熔点高
金刚石的用途:自然界存在的最硬的物质,切割玻璃、大理石、加工坚硬的金属,装在钻探机的钻头上钻凿坚硬的岩层。
石墨的性质 深灰色、有金属色泽,细鳞片状固体质软导电很高
石墨的用途①润滑剂 ②铅笔芯 ③作电极木炭、活性炭具吸附性(物理变化)
活性炭的用途:
(1)、防毒面具中滤毒罐利用活性炭吸附毒气(2)、冰箱的除味剂(3)、制糖工业的脱色剂收起
评论(4) | 210 2
斯坦福桥公主 | 四级 采纳率34%
擅长: 暂未定制
其他类似问题
2009-08-02初三化学知识点总结 1718
2008-12-01急求初三化学所有知识点的总结 228
2011-10-02初三化学知识点总结,尽量详细一点的,谢谢! 135
2010-10-23人民教育出版社:2010年高一物理必修一知识点总结 61
2009-01-29急求初三化学第是单元知识点总结!! 39
更多关于求初三到高一化学总结知识点的问题>>
网友都在找:
初三
按默认排序 | 按时间排序
其他6条回答
2009-01-06 10:02歌尽人醉 | 六级
我整理了4个小时
给点辛苦分啊~
初三化学笔记整理
一、基本概念
1.物质的变化: 物理变化:没有其他物质生成的变化—如三态变化等
化学变化:有其他物质生成的变化—如燃烧,金属生锈等
2.物质的性质: 物理性质:不需要发生化学变化就能表现出来—如颜色,状态,气味,熔沸点,硬度,密度,磁性,导电、热性等
化学性质:只有通过化学变化才能表现出来的—如助燃性,可燃性,毒性,
稳定性等
3.元素:具有相同质子数的一类原子叫做元素
分子:保持物质化学信纸的一种微粒
分子是由原子构成的
原子:化学变化中的最小微粒
根本区别:在化学变化中,分子能够再分,而原子不能
微粒的性质: 微粒是真实存在的,体积小,质量轻
微粒在不断做无规则运动
微粒之间有间隙
同种微粒性质相同,不同微粒性质不同
4.化合价:
常见元素的化合价:+1 钾、钠、银、氢、亚铜
+2 钙、镁、铜、钡、锌、亚铁
+3 铁、铝
+4 硅
-1 氟、氯、溴、碘
—2 氧、硫
+2/+4 碳
-2/+4/+6 硫
计算——根据化学式求某一元素化合价:物质中,各元素化合价为0
5.质量守恒定律:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和
6.物质的量---单位:摩尔(mol)
质量(m)=式量(M)*物质的量(n)
微粒个数(N)=阿伏加德罗常数(NA)*物质的量(n)
7.反应类型: 化合反应:A+B C
分解反应:A B+C
置换反应:A+BC B+AC
复分解反应:AB+CD CB+AD
8.氧化还原反应:物质跟氧反应叫做氧化反应’含氧化合物中的氧被夺去的反应叫做还原反应
失氧的物质发生还原反应,作氧化剂,具有氧化性
得氧的物质发生氧化反应,作还原剂,具有还原性
二、物质
1.混合物
①空气:组成: N2 78%---性质稳定,做保护气,化肥
O2 21%---供呼吸,有助燃性,氧化性,实验室制氧气:
固固加热型: 二氧化锰
氯酸钾 氯化钾+氧气
加热
固液不加热型:
过氧化氢 水+氧气
加热
CO2 0.03%---温室效应,不燃烧,不支持燃烧
实验室制二氧化碳(启普发生器使用限制:不能加热,也不耐热;固体反应物必须是不能溶于反应液的块状;产生的气体不能溶于反应液)
盐酸+大理石(碳酸钙) 二氧化碳+氯化钙+水
稀有气体 0.94%
氮、硫的化合物和可吸入颗粒物---衡量空气质量的指标
②溶液:水的组成: 通电
水 氢气+氧气
溶液的组成:溶质和溶剂
溶解性——饱和溶液(一定温度,一定溶剂下,不能再溶解某一种物质)
影响因素:温度,溶质性质,溶剂性质
溶解度:
程度 难溶 微溶 可溶 易溶
溶解度(g/100g水) 小于0.01 0.01~1 1~10 10以上
计算:S/100=溶质质量/溶剂质量(使用范围为饱和溶液)
溶解度曲线:可看出物质溶解度随温度变化情况
大多数物质的溶解度随温度升高而增大
小部分物质的溶解度随温度升高而减小(Ca(OH)2)
气体的溶解度随温度升高而减小,随气压增大而增大
提纯:降温结晶(冷却热饱和溶液)
适用于溶解度随温度升高而增大的物质
蒸发结晶
适用于溶解度岁温度升高而减小的物质
蒸发结晶
适用于溶解度随温度变化较小的物质
溶质的质量分数计算:C%=溶质质量/溶液质量*100%
C浓%*m浓= C稀%*m稀
两个三步曲:配制溶液:计算,称量,溶解
粗盐提纯:溶解,过滤,蒸发
③浊液:悬浊液:细小固体颗粒分散在水中
乳浊液:小液滴分散在水中
2.纯净物
①单质:金属单质:一般为“钅”字旁,如铜Cu,镁Mg(汞Hg除外)
非金属单质:一般为“气”字头,“石”字旁,如碳C,硫S,磷P,
氯Cl,氧气O2,氮气N2,碘I2(溴Br2除外,为液态)
稀有气体单质:氦He,氖Ne,氩Ar,氪Kr,氙Xe,氡Rn
②化合物:有机化合物:绝大多数含碳的化合物,除去一氧化碳,二氧化碳,碳酸以及碳酸盐等(一般难溶于水)
例如甲烷CH4,酒精C2H6O,醋酸CH3COOH,
葡萄糖C6H12O6
无机化合物:氧化物(只能含有两种元素,必须要有氧元素)
形式:一般为MO 如CO,CO2,H2O等
酸
形式:一般为HX 如HCl,H2CO3,HNO3等
碱 形式:一般为MOH 如NaOH,Ca(OH)2,Cu(OH)2等
盐
金属+酸根 如碳酸钙,氯化钠,碳酸氢钠(NaHCO3)
纯碱(碳酸钠)氯化铵(NH4Cl---但水溶液为酸性)
三、化学实验
1.常见的一起名称和图形
如酒精灯,试管,烧杯,铁架台,蒸发皿,量筒,玻璃棒等
2.氧气和二氧化碳的制取和收集
氧气——制取:加热高锰酸钾、加热氯酸钾和二氧化锰混合物、双氧水(加有二氧化锰)
收集:排水集气法,向上排空气法
二氧化碳——制取:大理石(碳酸钙)和稀盐酸(不能用浓盐酸,会挥发,导致收集到的气体不纯;也不能用大理石和硫酸,它们反应会生成硫酸钙,微溶于水,覆盖在大理石表面,阻止反应的进一步发生)
收集:向上排空气法
3.一氧化碳,二氧化碳,氧气的性质和装置
性质 一氧化碳 二氧化碳
颜色气味状态 无色无味气体 无色无味气体
溶解性 难溶于水 可溶于水
密度 与空气密度接近,略小于空气 比空气大
可燃性 在氧气中完全燃烧生成二氧化碳 无
跟碱溶液反应 无 二氧化碳与氢氧化钙反应
氧化性 无 二氧化碳与镁反应
还原性 一氧化碳还原氧化铜一氧化碳还原氧化铁 无
毒性 有毒,与血红蛋白结合,使其失去运输二氧化碳和氧气的功能(化学性质) 无
4.碳酸钙的性质: 高温
碳酸钙 氧化钙+二氧化碳
氧化钙+水 氢氧化钙
氢氧化钙+二氧化碳 碳酸钙+水
附注:
燃烧与灭火
1. 燃烧的条件:
可燃物
与氧气接触
达到着火点
2. 灭火的原理:
隔离可燃物
将可燃物于空气隔绝
将可燃物的温度降到着火点以下
常见灭火器
灭火器名称 原理 适用范围以及使用方法
泡沫灭火器硫酸+碳酸钠 硫酸钠+水+二氧化碳 灭火的时候,能喷射出大量的二氧化碳以及泡沫,它们能黏附在可燃物上,使得可燃物与空气隔绝,达到迷惑的目的 可用来扑灭木材,棉布等燃烧引起的火灾。平稳正拿,灭火的时候,一手握提环,一手握筒底,倒过来喷嘴对着火源,用力摇晃几下,即可灭火
干粉灭火器 加热碳酸氢钠 碳酸钠+水+二氧化碳 利用压缩的二氧化碳吹出的干粉(主要含碳酸氢钠)来灭火 具有流动性好,喷射性高,不腐蚀容器和不容易变质等优良性能,可用来扑灭一般的火灾之外,还可以用来扑灭油,气等燃烧引起的失火
液态二氧化碳灭火器 在加压的时候将液态二氧化碳压缩在小钢瓶中,灭火的时候再将其喷出,有降温和隔绝空气的作用 灭火的时候,不会留下任何残留痕迹而使物体损坏,可用来扑灭书,档案,贵重设备,精密一起等的失火。使用的时候手一定要先握在钢瓶的木柄上,否则会把手冻伤
无定性碳:木炭,活性炭,焦炭,炭黑
由石墨混有其他物质组成的物质
木炭 木材干馏 写生,制糖,工业吸附色
活性炭 胡桃,棉仔,或者花生壳等干馏,再活化处理 防毒面具,防毒剂
焦炭 煤干馏 冶炼金属
炭黑 用含碳物质进行不完全燃烧 油漆,鞋油,颜料
评论 | 20 0
2009-01-06 18:17gling002 | 四级
1.弄清楚概念问题,之间的区别和联系
2.化学符号要会写,要会配方
3.活泼性顺序和化合价,还有后面的化学元素表,相对原子质量要背
4.计算题要小心,找等式关系
5.各个物质的化学性质和物理性质也要熟悉
记住这些ok啦,考试时要小心哦~
评论 | 9 1
2009-01-03 21:18枫叶清铃 | 七级
展开全文











